سارکوم های اندام ها نادر بوده و برای بیمار و پزشکان مشکلاتی را ایجاد می کنند. پزشکانی که تومورهای استخوانی را درمان می کنند را جراح ارتوپد تومورهای استخوانی می نامند. استئوسارکوم شایع ترین بدخیمی استخوانی اولیه برای حفظ اندام است، اگرچه سرطان های استخوانی دیگری نیز وجود دارد.. اکثریت این سرطان های استخوانی در گروه سنی در حال بلوغ رخ می دهد. بخش کوچکتری در کودکان زیر ده سال رخ داده و بخشی نیز در افراد مسن که به بیماری دیگری مانند پاژه مبتلا هستند بعنوان یک بیماری ثانویه رخ می دهد. در گذشته، سرطان های استخوانی اندام با استفاده از قطع اندام درمان شده و نتایج عملکردی نسبتا ضعیفی داشتند. در 30 سال گذشته، حفظ اندام (عمل هایی برای حفظ اندام به جای قطع اندام) گسترش یافته اند. ثابت شده است که این تکنیک در بیشتر موارد ایمن و موثر است.

در حوزه های متعدد پیشرفت هایی در بهبود نتایج حفظ اندام وجود داشته است. اکنون از شیمی درمانی جدید یا کمک شده برای درمان بیشتر سارکوم های استخوانی استفاده می کنند. شیمی درمانی باعث مرگ تومور شده و برداشت ایمن تر آن را ممکن می سازد. علاوه بر آن، شیمی درمانی باعث می شود تا تومور دارای پوسته یا حاشیه شده و در برخی موارد کوچک شود و این مسئله به جراح کمک می کند تا تومور را کامل و بافت سالم را به میزان حداقلی بردارد. 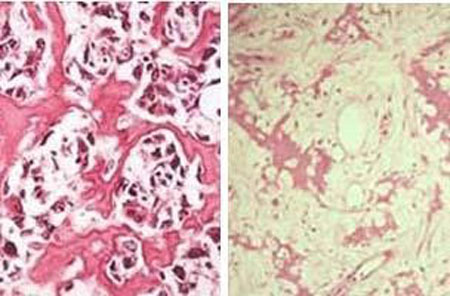
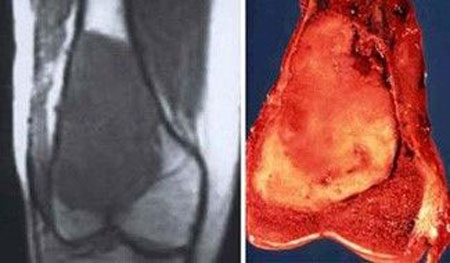
اگرچه در تمامی اسکلت بدن دیده می شوند، اما بیشتر استئوسارکوم ها در اطراف مفصل زانو و پایین فمور و بالای تیبیا قرار دارند. تومورها معمولا در متافیز یا دیافیز استخوان های بلند رخ می دهند. تومور به صفحه رشد تهاجم پیدا کرده و از آن عبور می کند. استئوسارکوما یک تومور مهاجم است که معمولا از استخوان به بافت نرم گسترش پیدا می کند. تومور می تواند مفصل، عضله، عصب و عروق نزدیک استخوان منشا تومور را درگیر کند. با پیشرفت، تومور استخوان را تخریب کرده و ممکن است منجر به شکستگی شود. 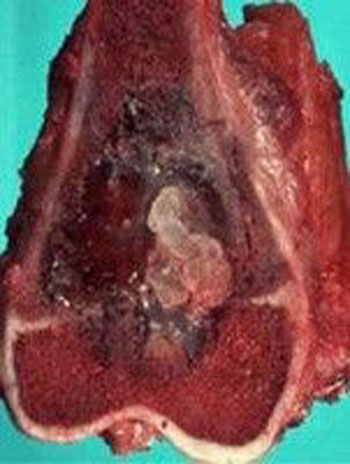
استئوسارکوما درمان نشده نادر است. اگر درمان نشده باقی بماند، تا میزان بسیار بزرگی رشد کرده و با پیشرفت خود استخوان را از بین می برد. شکستگی مرضی به طور اجتناب ناپذیری رخ می دهد، به خصوص در استخوان های تحمل کننده وزن. استئوسارکوما گرایش زیادی برای گسترش به ریه دارد. حضور متاستازهای کوچک در هنگام ظهور بیماری شایع بوده و یک دلیل شیمی درمانی است. بیماران در سطوح پایانی بیشتر به درگیری های ریوی دچار شده و استئوسارکوما به مناطق استخوانی و غیر استخوانی متاستاز می دهد. 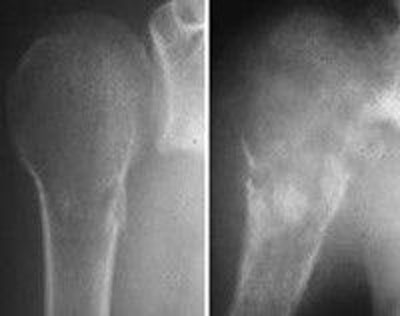
درمان غیر جراحی برای استئوسارکوما منطقی نیست، به جز مواردی که تومور از لحاظ آناتومی در محل های غیر قابل دسترسی قرار دارد. برای مثال یک تومور بزرگ در ستون فقرات. در این مورد، رادیوتراپی تسکینی (غیر درمانی) و شیمی درمانی می تواند استفاده شود.
حتی بیمارانی که به متاستاز ریوی دچار هستند به صورت تهاجمی و با شیمی درمانی و جراحی درمان می شوند. برخی از این بیماران با سطوح بالا می توانند درمان شوند. درمان مطلوب استئوسارکوما به برخی از انواع جراحی نیاز دارد. رادیوتراپی می تواند برای تومور های غیر قابل جراحی استفاده شود اما فقط تسکین دهنده بوده و درمانی نیست. درمان کنونی استئوسارکوما از شیمی درمانی نئوادجوانت (پیش از عمل) به مدت حدود سه ماه استفاده می کند. شیمی درمانی یا از طریق ورید (داخل وریدی) یا از طریق شریان (داخل شریانی) تجویز می شود. سپس، بیمار به صورت موضعی و کلی دوباره سطح بندی می شود تا تعیین شود که تومور متاستاز داده یا سایزش تغییر کرده یا نه. تصمیم گیری نوع جراحی (حفظ اندام یا قطع اندام) گرفته می شود. تومور برداشته شده توسط پاتولوژیست برای میزان نکروز ارزیابی می شود. رابطه مستقیمی بین نکروز (درصد مرگ تومور) و بقا وجود دارد. تومور هایی که 90 درصد یا بیشتر پس از شیمی درمانی دچار نکروز شده اند، پروگنوز خیلی خوبی دارند. شیمی درمانی به تنهایی برای کنترل تومور درون استخوان کافی نیست. جراحی نیز برای برداشت باقی مانده سلول های زنده تومور نیاز است. پس از جراحی، برای بیماران تا یک سال شیمی درمانی گذاشته می شود. اگر بیماری ریوی به وجود آید، غدد را می توان با جراحی برداشت.
سارکوم گروهی از تومورهای بدخیم هستند که عموما از استخوان ، عضله ، چربی و یا عصب در اندامها منشا می گیرند. اگر بخواهیم آنها را به دو گروه بزرگ تقسیم کنیم گروه اول سارکوم های استخوانی هستند که سر دسته آنها استئوسارکوم ، کندروسارکوم و سارکوم یوئینگ است. سارکوم های استخوانی معمولا با درد و تورم در استخوان اندام مشخص می شوند هرچه تشخیص آنها سریعتر باشد مسلما امکان درمان و بهبودی کامل بیشتر است. لذا هر نوع درد که بیش از سه هفته در یک ناحیه از اندام بماند و روند بهبودی نداشته باشد باید جدی گرفته شود. بر عکس اگر در زمان تشخیص بیماری در بدن گسترش پیدا کرده باشد نشانه خوبی نیست و درمان کامل را نمی توان انتظار داشت. عموما بعد از انجام عکس رادیولوژی و ام آر آی برای تشخیص نیاز به نمونه برداری یا بیوپسی است. انجام نمونه برداری برخلاف تصور خیلی از افراد ، باعث پخش شدن تومور در بدن نمی شود و این یک عقیده نادرست است. عموما بعد از یک هفته تا ده روز جواب نمونه برداری با جزییات مشخص می شود. هر چه درجه بدخیمی سارکوم پایینتر باشد احتمال پاسخ به درمان بیشتر خواهد بود و بر عکس سارکوم های با درجه بالای بدخیمی تمایل بسیار به گسترش سریع در بدن و عدم پاسخ به درمان دارند. معمولا بعد از مشخص شدن نوع تومور در سارکوم های استخوانی ابتدا شیمی درمانی انجام می شود و بعد از آن عمل جراحی برای بیمار انجام خواهد شد. البته کندروسارکوم یک مورد استثنا است که در آن شیمی درمانی فایده ای ندارد و باید فقط جراحی شود. پاسخ تومور به شیمی درمانی و میزان تخریب آن در دوره مصرف داروهای شیمی درمانی یک فاکتور بسیار مهم در درمان سارکوم استخوان می باشد. اصولا سارکوم هایی که بدنبال شیمی درمانی کوچک می شوند و بخشی از هسته مرکزی آنها از بین می رود احتمال بهبودی و درمان بسیار بالایی دارند و برعکس در مواردی که اندازه سارکوم حین شیمی درمانی بزرگتر و به قسمت های دیگر بدن پخش می شود نشانه عدم پاسخ و رفتار تهاجمی و پیش آگهی بد سارکوم خواهد بود. جراحی در سارکوم استخوان بایستی توسط یک ارتوپد فوق تخصص تومور انجام شود و عموما یک عمل جراحی بزرگ و پیچیده با تکنیک های خاص است که تجربه بالای جراح می تواند بسیار در موفقیت آن نقش داشته باشد. چنانچه یک سارکوم استخوان با حاشیه پاک و اصطلاحا عاری از تومور برداشته شود نقش بسیار مهمی در درمان و جلوگیری از برگشت تومور و درمان نهایی آن خواهد داشت. لذا محل سارکوم از نظر امکان جراحی با هدف بالا نقش مهمی دارد و در مواردی که سارکوم در محل هایی مثل لگن یا ستون مهره رخ می دهد امکان جراحی آن با حاشیه پاک و رسیدن به هدف مهم جراحی که برداشتن کامل تومور است غیر ممکن خواهد بود. بعد از انجام جراحی بیمار مجددا شیمی درمانی می شود و در صورتی که که همه چیز خوب پیش رود اصطلاحا بیمار در مرحله بهبودی موقتی یا ناکامل قرار گرفته و اگر بعد از بررسی های دوره ای که معمولا هر شش ماه صورت می گیرد و تا پنجسال ادامه دارد علامتی از برگشت تومور یا پخش شدن آن در سایر بخش های بدن دیده نشود بیمار وارد درمان کامل شده و حتی می تواند طول عمری مشابه سایر افراد باشد. بنابراین احتمال درمان و بهبودی کامل در سارکوم های استخوان به موارد زیر بستگی دارد:
تصمیم اولیه درباره جراحی را امکان حفظ اندام مشخص می کند. بیشتر استئوسارکوم ها (نزدیک 85 درصد) کاندیدای حفظ اندام هستند. برخی ممنوعیت های نسبی وجود دارد. تومور های بزرگ رشد کننده به شیمی درمانی خوب پاسخ نداده و غالبا با قطع اندام بهتر درمان می شوند. بیمارانی که تومور های درگیر کننده پوست اطراف استخوان دارند کاندیدا های نامناسبی برای حفظ اندام هستند. سرطان های احاطه کننده عصب ها و شریان های مهم ممکن است نیاز به قطع اندام داشته باشند. سارکوماهای در کودکان با سن پایین از طریق قطع اندام بهتر کنترل می شوند. در این بیماران جوان، طول غیر همسان اندام پس از حفظ اندام زیاد بوده و باعث عدم عملکرد می شود. 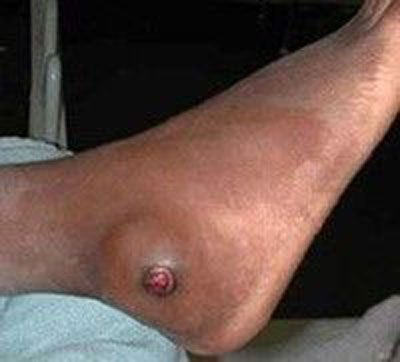
مکانسیم مفصل نیز بسیار پیچیده بوده و می تواند بیمار را به راه رفتن معمول بازگرداند. بیماران دچار قطع اندام زیر زانو معمولا بدون لنگش راه رفته و می توانند بیشتر ورزش ها را انجام دهند. بیشتر مشاهده گران از بیرون حتی متوجه نمی شوند که بیماری که شلوار به پا دارد، قطع عضو شده است. بیماران دارای قطع اندام بالای زانو نیز می توانند عملکرد خیلی خوبی داشته باشند. اگرچه آنها غالبا یک لنگش کوچک داشته و می توانند ورزش های زیادی انجام دهند، اما نمی توانند به اندازه بیماران قطع اندام زیر زانو عملکرد داشته باشند زیرا در اندام مصنوعی خود به یک مفصل مصنوعی زانو نیاز دارند. قطع اندام از بالای پا (از مفصل ران) می تواند مناسب باشد اما عملکرد محدود است. قطع اندام نزدیکتر به مفصل ران نسبه به قطع عضو از پایین تر، نیاز به انرژی بیشتری از بیمار برای راه رفتن دارد.
یک نوع آمپوتاسیون یا قطع اندام بنام وان نس یا روتیشن پلاستی هست که در آن پا ، ساق و مچ پا حفظ میشود و در وضعیت وارونه مجددا به باقیمانده ران وصل میشود بطوری که مچ پا در این حالت نقش زانو را دارد این روش باعث میشود قطع اندام از ناحیه ران تبدیل به یک قطع اندام زیر زانوشده که به مراتب کارایی بیشتری دارد. در حالی که این بازسازی همواره بیماران و خانواده آنها را وقتی در ابتدا از آن با خبر می شوند ناراحت می کند، اما گزینه فوق العاده ای بوده و به این کودکان اجازه می دهد تا در بیشتر فعالیت های طبیعی کودکی شرکت داشته باشند. قطع عضو شانه، بازو ساعد نتایج عملکردی ضعیف تری از قطع اندام از ران یا پایین پا دارد. اگر قطع عضو از مفصل شانه باشد این موضوع صحت بیشتری دارد. عضو نهایی مصنوعی تنها توانایی محدودی در بازگرداندن قدرت و مهارت دارد. اندام مصنوعی مایوالکترونیک ممکن است برخی از این نقایص را بهبود بخشد.
پس از تصمیم درباره حفظ اندام، دو نوع اساسی بازسازی در بزرگسالان وجود دارد. بیشتر استئوسارکوماها درگیر کننده مفصل زانو هستند که نیاز به برداشت شدن در حین جراحی دارند. بازسازی با جراحی گزینه ای است که شامل آرترودز یا آرتروپلاستی می شود.
آرترودز / فیوژن یا ادغام مفصلی نوعی جراحی است که مفصل را به طور دائم خشک یا فیوز می کند. مفصل زانو دیگر خم نخواهد شد. این اتفاق می تواند با پیوند استخوانی آلوگرافت، اتوگرافت دارای عروق یا ترکیب هر دو به دست آید. وقتی زانو به طور محکم ادغام شد، یک ساختار پایدار و با دوام است. می تواند فشار فیزیکی را تحمل کند. احتمال نیاز به جراحی های بعدی در آرترودز پایین است.
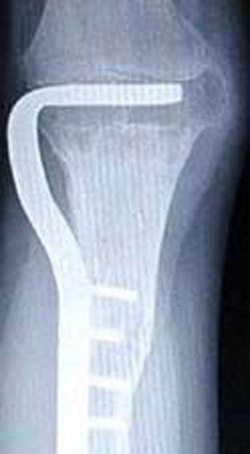
آرتروپلاستی یک زانوی قابل خم شدن را فراهم می آورد. این جراحی مفصل و استخوان برداشته شده را جایگزین می کند. آرتروپلاستی می تواند با پیوند آلوگرافت یا یک اندام مصنوعی فلزی به دست آید. آرتروپلاستی آلوگرافت استخوان و مفصل برداشته شده را با یک استخوان پیوندی جایگزین می کند. این بافت پیوندی از یک اهداکننده انسانی برداشت شده و برای کاهش مشکلات پس زدن، یخ زده شده اند. یخ زدن باعث مرگ استخوان شده و غضروف را به طور حداقلی زنده نگه می دارد. بافت پیوندیی باید به استخوان میزبان مثل یک شکستگی جوش بخورد. این جوش خوردن به علت شیمی درمانی پس از جراحی دچار مشکل می شود. 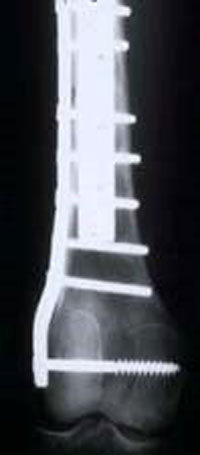
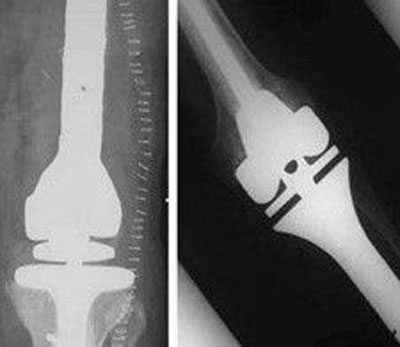
جراحی حفظ اندام برای تومور زانو دو مرحله اصلی دارد: برداشت سرطان و بازسازی.
اولین بخش جراحی برداشت کامل سرطان با حاشیه مناسب است. جراح باید مطمئن باشد که زانو آلوده به سلول های تومور نیست. اگر نفوذ به مفصل وجود دارد، مفصل به طور کامل برداشته می شود. بازسازی منطقی پس از این کار ادغام زانو است. بیشتر اوقات، مفصل می تواند باز شده و پایین فمور یا بالای تیبیا برداشته شود. عضلات پوشاننده بخش های بافت نرم تومور نیز برای بهبود حاشیه برداشت، برداشته می شوند. اعصاب و عروق پشت استخوان معمولا شناسایی شده و حفاظت می شوند. پیش از عمل، برش استخوان بر اساس ام آر آی مشخص می شود. زمانی که سرطان به طور مناسب برداشته شد، نمونه باز می شود تا اطمینان حاصل شود که حاشیه برداشته شده مناسب است.
بخش بعدی جراحی بازسازی است. اگر یک اندام مصنوعی مخصوص سرطان برای بازسازی مطلوب باشد، درون کانال استخوان فمور بوسیله ابزارهای مناسب آماده شده و پروتز متناسب با قطر تنه فمور انتخاب می شود. سپس تیبیا با برداشت سطح غضروفی و آماده ساختن کانال آماده می شود. پروتز آزمایشی، سر هم بندی شده و داخل استخوان از جهت طول، پایداری و حرکت کشکک کنترل می شود. سطح کشکک می تواند به شکل مطلوب بازسازی شود. پروتز مخصوص سرطان نهایی می تواند با سیمان یا بدون سیمان قرار داده شود. دستگاه های بدون سیمان متخلخل بوده و رشد استخوانی برای موفقیت عمل ضروری است. این مسئله می تواند در هنگام شیمی درمانی بعنوان مشکل تلقی شود. زخم با لایه های مختلف پوشیده می شود. رباط ها نیاز به ترمیم ندارند زیرا یاتاقان در حال چرخش لولا برای مفصل پایداری ایجاد می کند. برای تومور های تیبیا، پیوند های عضلانی برای اتمام ترمیم رباط کشکک مورد نیاز هستند. آرتروپلاستی آلوگرافت نیاز به تثبیت استخوان به فممور با استفاده از میله و صفحه دارد. ثابت سازی داخلی سخت برای تسریع بهبودی مورد نیاز است. پیوند آلوگرافت باید سایز مناسب داشته باشد تا مطابق با استخوان و مفصل برداشته شده باشد. تمام رباط ها باید به پیوند آلوگرافت بخیه شوند تا مفصل پایدار شود. ناپایداری یک مشکل عمده در آرتروپلاستی آلوگرافت است.
به طور کلی عوارض بالقوه حفظ اندام بیش از قطع اندام است.
در زمان اذیت کردن، درد شبح و نوروما را می توان به طور معمول با دارو و در برخی موارد با یک جراحی کوچک کنترل کرد.
عوارض آرتروپلاستی با اندام مصنوعی مخصوص سرطان متعدد است اما معمولا قابل کنترل هستند.
پس از قطع اندام تحتانی (پا) جراح می تواند یک اندام مصنوعی موقت با پوشش نرم را در آن جا قرار دهد. اندام مصنوعی موقت عملکرد بازتوانی سریعتر را ممکن ساخته و برای قطع عضو بالای زانو یا پایین تر از آن مناسب است. ممکن است از یک اندام مصنوعی ساز خواسته شود تا شکل یک اندام مصنوعی را در اتاق عمل گچ گیری کند. فیزیوتراپی به سرعت برای علل عملکردی و روحی روانی آغاز می شود. درمان شامل تمرین راه رفتن، حرکت دادن مفصل و قدرت بخشی به عضلات می شود. اگر پوشش نرم به کار رفت، باید به بیمار آموزش داده شود تا جهت کاهش تورم اندام را بپوشاند. ساخت اندام مصنوعی معمولا برای سه ماه به تعویق می افتد تا عضو شکل طبیعی خود را دوباره به دست آورد. پس از اینکه پا آماده شد، به بیمار آموزش داده می شود که چگونه از آن استفاده کند. هر چه سطح قطع عضو بالاتر باشد، تمرین بیشتری نیاز است. بیماران با قطع عضو سطوح بالا ممکن است از بستری در یک مرکز بازتوانی سود ببرند. قطع عضو از سطوح بالا نیاز به بازتوانی بیشتر شغلی و فیزیوتراپی دارد. استفاده از اندام مصنوعی آموزش داده شده و به بیمار دستور العمل هایی برای استفاده از اندام مقابل برای فعالیت های روزمره داده می شود.
حفظ اندام با استفاده از وسایل مخصوص سرطان نیاز به بازتوانی اختصاصی دارد. پس از مدت کوتاهی پس از جراحی بیمار برای تمارین راه رفتن، وسعت حرکتی زانو و تقویت عضلات به فیزیوتراپی می رود. اگر وسیله بدون سیمان جای گذاری شده باشد، جابجایی نسبی با تحمل وزن برای 6 هفته ضروری است. ترمیم بافت نرم پس از حفظ اندام اثر قابل توجهی روی بازتوانی دارد. اگر بازسازی چهارسر انجام شده باشد، به خصوص برای تومور های تیبیا، ترمیم باید پیش از فعالیت های ورزشی کامل شود. این مسئله معمولا در هفته ششم رخ می دهد. ورزش های وسعت حرکتی تحت تاثیر خشکی و حرکات کشکک قرار دارد. حفظ اندام با پیوند آلوگرافت تقریبا نیاز به نوع دیگری از بازتوانی دارد. آلوگرافت باید با استفاده از یک وسیله کمکی برای راه رفتن تا زمان جوش خوردن استخوان میزبان و آلوگرافت حفاظت شود. کودکان به طور خاص باید هنگام روند بازتوانی تشویق شوند. در حالی که در حال انجام شیمی درمانی هستند، آنها سطح انرژی پایینی داشته و انگیزه کمی برای ورزش دارند. یک تمایل زیاد در کودکان برای انقباض و خم کردن زانو وجود دارد و از این مسئله باید اجتناب شود. به طور کلی، بیماران دارای پروتز مخصوص سرطان سیمانی سریعتر از دیگر مدل های حفظ اندام یا قطع اندام بهبود می یابند.
کلینیک فوقتخصصی پزشکی و توانبخشی ارتوپدی و نورولوژی «تهران ارتوپدی» با هدف ارائه خدمات جامع توانبخشی و ارتقای کیفیت زندگی بیماران، خدمات خود را در گستره وسیعی از مناطق تهران ارائه میدهد. این مرکز با بهرهگیری از تیمی متخصص و تجهیزات پیشرفته، پذیرای مراجعان از شمال، شرق، غرب و مرکز تهران است. مناطق تحت پوشش شامل منطقه یک ، الهیه، خیابان فرشته، شهرک غرب، تجریش، قیطریه، پاسداران، اختیاریه، ولنجک، نیاوران، ونک، مرزداران، شهرآرا، یوسفآباد، امیرآباد، نارمک، نیروهوایی، زعفرانیه، آجودانیه، جردن، پونک، صادقیه، محمودیه ، لویزان، شهرک راهآهن و سعادتآباد میباشد.
سلام وقتتون بخیر
خیلی این مطلب مفید بود ممنون
برای درد شانه، شما میتوانید به پزشک عمومی، متخصص فیزیوتراپی ورزشی، متخصص ارتوپدی، یا متخصص روماتولوژی مراجعه کنید. در مراجعه اولیه خود، پزشک عمومی ممکن است شما را به یک پزشک متخصص مرتبط ارجاع دهد.