مولتیپل میلوما یک بدخیمی هماتولوژیک است. 98 درصد از بیماران 40 سال یا بیشتر سن داشتند و 61 درصد نیز مرد بودند. 68 درصد بیمارن درد استخوانی، 62 درصد کم خونی، 55 درصد نارسایی کلیوی، 30 درصد هایپرکلسمی، 21 درصد کبد قابل لمس و 5 درصد طحال قابل لمس داشتند. ناهنجاری skeletal roentgenographic در 79 درصد بیماران دیده شد. در این مقاله از سایت تهران ارتوپدی به بررسی MMBD یا بیماری استخوان مولتیپل میلوما می پردازیم.
مولتیپل میلوما باعث ایجاد یک بیماری استخوانی استئولیتیک و پیشرونده (بیماری استخوانی استئولیتیک یکی از علل اصلی morbidity در بیماران مبتلا به مالتیپل میلوما است) که همراه با درد شدید استخوان، شکستگیهای پاتولوژیک، پوکی استخوان، هیپرکلسمی و فشار به نخاع میشود. MMBD یا بیماری استخوانی مولتیپل میلوما با افزایش فعالیت استئوکلاستها و کاهش یا عدم فعالیت استئوبلاستها باعث ضایعه پانچ (punched-out) در تصاویر رادیولوژیک استخوان میشود.

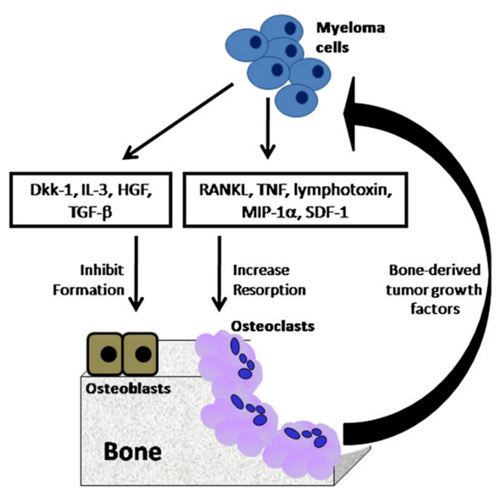
سلولهای میلوما با مکانهای تحلیل فعال استخوان ارتباط دارند و تعامل بین سلولهای میلوما، استئوکلاستها، سلولهای استرومایی، فیبروبلاستهای مرتبط با میلوما و استئوبلاستها برای ایجاد بیماری استئولیتیک استخوان و برای رشد و بقای سلولهای میلوما در مغز استخوان حیاتی هستند. مشخص شده است که تخریب استخوان عمدتاً توسط استئوکلاستها انجام میشود و این تخریب با کاهش تشکیل استخوان همراه است و تشدید میشود. بیماران مبتلا به مالتیپل میلوما دارای بازسازی غیرطبیعی استخوان هستند، جایی که تحلیل و تشکیل استخوان از تنظیم خارج میشوند که نتیجه نهایی آن افزایش تحلیل استخوان و کاهش استخوانسازی است.
مطالعات Histomorphometric نشان داده است که تحلیل استخوان در بیماران مبتلا به مالتیپل میلوما با افزایش تعداد و فعالیت استئوکلاستها همراه است. تصور میشود که افزایش جذب استخوانی زودرسترین عامل در ایجاد بیماری استخوانی مالتیپل میلوما میباشد، در مراحل اولیه مالتیپل میلوما استئوبلاستها افزایش مییابند، ولی در مراحل بعدی بیماری کاهش تعداد و فعالیت استئوبلاستها دیده میشود. سلولهای میلوما در مجاورت محلهای تحلیل فعال استخوان گواه این است که مکانیسم تخریب استخوان توسط استئوکلاستها به صورت موضعی است و پوکی استخوان عمومی مرتبط با مالتیپل میلوما، در اثر کاهش استخوانسازی به دلیل تنظیم سیستمیک توسط عواملی مثل RANKL، OPG، MIP-1α، SDF-1، TGF-β، Dkk1 و sFRP-2 است. تنظیم بسیاری از این عوامل در بیماران مبتلا به مالتیپل میلوما با مختل است و هر کدام خود به تنهایی یا با بقیه ی فاکتورها در تحلیل استخوان یا کاهش تشکیل آن نقش دارند.
سلول میلوما فاکتورهای فعال کنندهی استئوکلاستی که باعث فرمیشن و فعال شدن استئوکلاستها که شامل لینفوتوکسین، TNF-α، IL-1 ، IL-3 و IL-6 است را ترشح میکند.
بیماری استخوان مالتیپل میلوما
RANKL روی سطح سلولهای استئوبلاست و سلولهای استرومایی مغز استخوان بیان شده و تعامل بین RANKL و گیرنده سیگنال دهنده RANK در سطح سلول پیش ساز استئوکلاست، باعث فعال شدن استئوکلاست و تحلیل استخوان میشود. OPG توسط سلولهای استرومایی مغز استخوان و استئوبلاستها ترشح میشود و به RANKL متصل شده و آن را مهار میکند و باعث مهار تحلیل استخوان میشود. در بیماران مالتیپل میلوما بیان RANKL توسط سلولهای استرومایی مغز استخوان و استئوبلاستها و بیان RANKL توسط سلولهای میلوما افزایش یافته است و همزمان سطح سرمی OPG و بیان آن آن کاهش مییابد. خود سلولهای میلوما OPG را بیان یا ترشح نمیکنند و در تعامل با سلولهای استرومایی مغز استخوان و استئوبلاستها غلظت OPG آزاد شده از آنها را کاهش میدهند.
MIP-1α توسط سلولهای میلوما تولید میشود و باعث تشکیل استئوکلاست میشود، بنابراین پتانسیل درمانی برای درمان بیماری استخوانی میلوما را دارد. در بیماران مبتلا به مالتیپل میلوما، سطح سرمی MIP-1α با شدت بیماری استخوان و بقا مرتبط است. MIP-1α با چندین گیرنده کموکاینی تعامل دارد، و اثر استئوکلاستوژنیک آن توسط گیرندههای کموکاین CCR1 و CCR5 است که نشان دهندهی پتانسیل درمانی آنتاگونیستهای این گیرندهها در بیماری استخوان میلوما را است. MIP-1α واسطه اصلی تخریب استئوکلاستیک استخوان در بیماری استخوانی میلوما است و ممکن است یک هدف درمانی برای درمان بیماری استخوان میلوما باشد.
اکثر سلولهای میلوما میتوانند VEGF ترشح کنند. VEGF نقش مهمی در القای نئوواسکولاریزاسیون در تومورهای جامد دارد، با این حال، مشخص شد که تراکم رگهای کوچک در مغز استخوان در بیماران میلوما با پیشرفت بیماری و پیش آگهی ضعیف مرتبط است. همچنین VEGF میتواند جایگزین M-CSF شود و باعث القای تمایز استئوکلاستها شود. مهار VEGF و استئوپونتین تقریباً به طور کامل رگزایی و تحلیل استخوان افزایش یافته توسط هم مکانی بین سلولهای میلوما و استئوکلاستها را مهار میکند.
فاکتور 1 آلفا مشتق از استرومال (SDF-1; CXCL12) یک کموکاین CXC است توسط سلولهای استرومایی مغز استخوان و سلولهای اندوتلیال بیان میشود. گیرنده آن CXCR-4 است که بر روی سلولهای بنیادی خونساز، لنفوسیت ها، سلولهای بدخیم و پیشسازهای استئوکلاست قرار دارد. SDF-1 و CXCR-4 نقش مهمی در لانه گزینی سلولهای بنیادی خونساز، مهاجرت و تکثیر تومور دارد. SDF-1 میتواند با بیان بیش از اندازه ژنهای مرتبط با فعالسازی استئوکلاستها از جمله RANK، RANKL، TRAP، MMP-9، CA-II و کاتپسین K تحرک استئوکلاستها و فعالیت جذب استخوان را نیز افزایش دهد.
سلولهای میلوما در ارتباط با مکانهای تحلیل فعال استخوان هستند و برهمکنش مستقیم سلول به سلول نقش مهمی در رشد تومور و توسعه بیماری استخوان میلوما ایفا میکند. اتصال سلولهای میلوما به سلولهای استرومایی مغز استخوان، مسیر NF-kB را فعال میکند و باعث تحریک رشد سلولهای میلوما، افزایش بقا، مقاومت دارویی و مهاجرت آنها میشود. فعل و انفعالات بین سلولهای میلوما و سلولهای استرومایی مغز استخوان باعث تنظیم فاکتورهایی از جمله IL-6 و RANKL میشود که باعث افزایش استئوکلاستوژنز میشوند. برهمکنش بین اینتگرین α4-β1 و VCAM-1 تولید عوامل تحریک کننده فعالیت استئوکلاستی را افزایش میدهد. برهمکنشهای بین سلولهای استرومایی مغز استخوان و سلولهای میلوما نیز بیان RANKL را توسط سلولهای استرومایی مغز استخوان افزایش میدهد.
برهمکنش بین سلولهای میلوما و استئوبلاستها یا سلولهای استرومایی مغز استخوان باعث کاهش تولید OPG میشود. MIP-1α چسبندگی سلولهای میلوما به سلولهای استرومایی مغز استخوان را با برهمکنش با CCR1 روی استئوکلاستها و CCR5 روی سلولهای میلوما افزایش میدهد، بنابراین رشد میلوما و توسعه بیماری استخوان میلوما را افزایش میدهد. سلولهای میلوما علاوه بر تعامل با سلولهای استرومایی مغز استخوان، مستقیماً به استئوکلاستها نیز میچسبند و باعث افزایش تکثیر سلولهای میلوما و افزایش تمایز استئوکلاستها میشوند. همچنین فعل و انفعالات بین سلولهای میلوما و استئوکلاستها منجر به افزایش ترشح فاکتورهای پروآنژیوژنیک و افزایش تشکیل عروقی میشود. 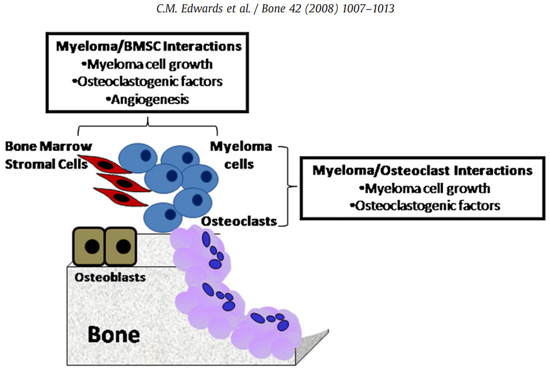
کاهش در تشکیل استخوان نقش مهمی در ایجاد بیماری استخوان میلوما ایفا میکند که منجر به تحلیل عمومی استخوان و ناتوانی در ترمیم ضایعات استئولیتیک که نتیجهی افزایش تحلیل استخوان است، میشود. عوامل Dkk1، sFRP-2، IL-3، Runx2 و TGF-β در سرکوب ایجاد و تمایز استئوبلاست در مالتیپل میلوما نقش دارند.
Dkk1 به عنوان واسطه در اختلال عملکرد استئوبلاستها در بیماری استخوان میلوما شناسایی شده است که توسط استئوبلاستها، سلولهای استرومایی مغز استخوان و سلولهای میلوما بیان میشود و تشکیل استخوان در استئوبلاستها را مهار میکند. علاوه بر این، فعل و انفعالات بین سلولهای میلوما و سلولهای بنیادی مزانشیمی باعث رشد سلولهای میلوما میشود که منجر به افزایش Dkk1 و در نتیجه مهار تمایز سلولهای بنیادی مزانشیمی به استئوبلاست میشود. درمان با آنتیبادی ضد Dkk1 ضایعات استخوانی استئولیتیک را کاهش میدهد، تعداد استئوبلاستها را افزایش میدهد و مقدار تومور را بهطور قابلتوجهی کاهش میدهد. پروتئین sFRP-2 یک آنتاگونیست محلول سیگنالینگ Wnt است که توسط سلولهای میلوم انسانی بیان میشود. sFRP-2 اگزوژن و sFRP-2 مشتق از سلول میلوما در تشکیل استخوان نقش دارند.
TGF-β از ماتریکس استخوان در طی تحلیل استخوانی استئوکلاستیک آزاد میشود و باعث مهار تمایز استئوبلاست میشود.
Runx 2 یک فاکتور رونویسی است که باعث تشکیل و تمایز استئوبلاستها از سلولهای بنیادی مزانشیمی میشود. سلولهای میلوما فعالیت Runx 2 را مهار میکنند و تمایز استئوبلاستها را کاهش میدهند.
اثرات مهاری غیرمستقیم IL-3 بر تمایز استئوبلاستهاست که در نتیجه افزایش تعداد سلولهای خونساز CD45+ است. IL-3 بهعنوان یک فاکتور بیماری استخوان میلوما، با اثر دوگانه بر افزایش مستقیم تحلیل استخوان استئوکلاستیک و مهار مستقیم تمایز استئوبلاست شناسایی شده است.
HGF توسط سلول میلوما تولید میشود و در سرم افراد مبتلا افزایش مییابد. سطح آن با پروگنوز ضعیف مرتبط است. سطح سرمی HGF با با سطح آلکالن فسفاتاز استخوانی رابطه عکس دارد و همچنین HGF بیان فاکتورهای Runx2 و Osterix را مهار میکند.
مهار پروتئازوم یک استراتژی درمانی جدید در درمان مالتیپل میلوما است که بر اساس حساسیت فوق العاده سلولهای میلوما به فعالیت پروتئازوم است. بورتزومیب (Velcade™-PS-341) یک مهارکننده قوی رشد و بقای سلولهای میلوما است و نتایج نشان دهنده اثربخشی درمانی قابل توجه و سمیت قابل قبول بورتزومیب داخل وریدی در بیماران مالتیپل میلوما است که به تنهایی یا همراه با دگزامتازون و یا داروهای شیمی درمانی دیگر پس از عود یا در اولین مراجعه تجویز شوده است. علاوه بر سلولهای میلوما، استئوبلاستها نیز به مهارکنندههای پروتئازوم حساس هستند و مهارکنندههای مسیر ubiquitin-proteasome (از جمله بورتزومیب) اثرات آنابولیک مفیدی بر روی اسکلت بدن دارند.
همچنین، مهارکنندههای پروتئازوم، تشکیل استئوکلاست و تحلیل استخوان را مهار میکنند. بورتزومیب مقدار تومور را کاهش میدهد و تراکم استخوان را افزایش میدهد، اثری که توسط افزایش استئوبلاستها و کاهش استئوکلاستها انجام میشود. درمان بورتزومیب همچنین منجر به کاهش Dkk1 و RANKL سرم میشود. بنابراین، بورتزومیب ممکن است هم برای درمان میلوما و هم برای بیماری استخوان مرتبط موثر باشد.
رویکردهای درمانی فعلی برای درمان بیماری استخوانی میلوما شامل استفاده از بیس فسفونات ها، پرتودرمانی، جراحی، کیفوپلاستی و ورتبروپلاستی است. بیس فسفوناتها در درمان بیماری استخوان میلوما موثر هستند، اما به دلیل مهار تشکیل استخوان جدید و ایجاد استئونکروز فک در 4 تا 6 درصد از بیماران میلوما که بیس فسفوناتهای داخل وریدی دریافت میکنند، کمتر استفاده میشوند. اختلال در سیستم RANKL-OPG یک مکانیسم حیاتی در ایجاد بیماری استخوان میلوما است. تلاشهای اولیه برای هدفگیری این سیستم از یک ساختار OPG نوترکیب (AMGN-0007) استفاده کرد که به خوبی تحمل میشد و باعث کاهش سریع و پایدار وابسته به دوز تحلیل استخوان شد، با این حال، نگرانی در مورد توسعه آنتی بادیهای OPG مانع از توسعه بیشتر این دارو شد.
اخیراً، یک آنتی بادی مونوکلونال انسانی برای RANKL ساخته شده است (Denosumab, AMG 162). این آنتی بادی اختصاصی RANKL است و به هیچ یک از اعضای دیگر خانواده TNF متصل نمیشود. یک دوز زیر جلدی دنوزوماب به خوبی تحمل شده و باعث کاهش پایدار در مارکرهای تحلیل استخوان میشد. 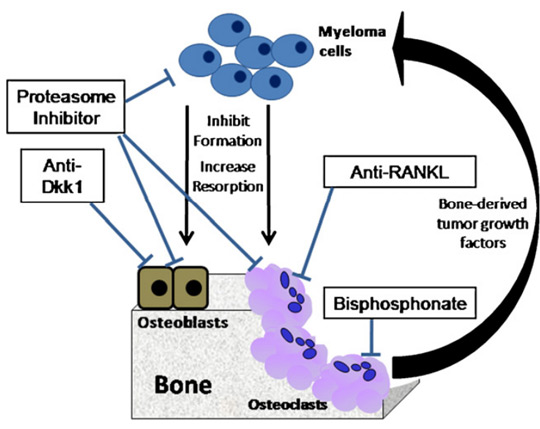
Robert A Kyle. Multiple myeloma: review of 869 cases. Mayo Clinic Proceedings 50 (1), 29-40, 1975
Claire M. Edwards, Junling Zhuang a, Gregory R. Mundy b. The pathogenesis of the bone disease of multiple myeloma. Vanderbilt Center for Bone Biology, Department of Cancer Biology, Vanderbilt University, Nashville, Tennessee, USA. Vanderbilt Center for Bone Biology, Department of Medicine/Clinical Pharmacology, Vanderbilt University, Nashville, Tennessee, USA. J. bone.2008.01.027
Deborah L Galson 1, Rebecca Silbermann 2 and G David Roodman 2. Mechanisms of multiple myeloma bone disease. epartment of Medicine, Division of Hematology / Oncology, University of Pittsburgh, Pittsburgh, PA, USA. 2Department of Medicine, Division of Hematology / Oncology, Indiana University, Indianapolis, IN, USA. 135(2012)